Contoh Soal Hukum Termodinamika 2

Hai Sobat
Pada kesempatan kali ini kita akan membahas hukum fisika termodinamika
Siapa yang sudah pernah belajar termodinamika?
Langsung saja ya kita mulai pembahasannya.
Pengertian Termodinamika
Termodinamika merupakan ilmu fisika yang mempelajari usaha tentar mengbah kalor (perpindahan energi yang disebabkan oleh perbedaan panas) menjadi energi dan sifat yang dibawanya.
Sodara sodara termodiamika ialah si fisika energi, entropi, panas, kespontanan proses, dan kerja. Secara sederhana termodinamika adalah ilmu yang mempelajari fenomena perpindahan panas pada suatu objek.
Termodinamika ini dirumuskan berdasarkan prinsip prinsip dibawah ini.
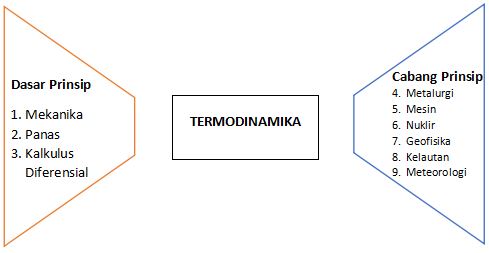
Prinsip Termodinamika
Gambar diatas menjelaskan bahwa termodinamika lahir berkat tiga prinsip dasar atau bidang ilmu dasar tersebut yang berkolaborasi menjadi hukum termodinamika.
Setelah menjadi hokum termodinamika kemudian dapat dimanfaatkan oleh banyak sekali cabang diantaranya enam cabang yang terlihat di atas.
Sangat besar sekali penerapan hokum termodinamika dalam kehidupan sehari hari. Selanjutnya kita akan bahaslebih dalam tentang hokum termodinamika 1, 2, dan 3. Mari kita simak bersama.
Hukum 1 Termodinamika
Hukum 1 termodinamika menyatakan tentang kasus kekekalan energi. Di sini dijelaskan bahwa perubahan energi dalam dari suatu sistem termodinamika sistem tertutup, sama dengan total dari jumlah energi kalor yang diberikan ke dalam sistem dan kerja yang dikerjakan terhadap sistem tersebut.
Dari sini dapat diuraikan menjadi beberapa proses termodinamika antara lain:
- Isokhorik
- Isobarik
- Isotermik
- Adiabatik
Hukum 2 Termodinamika
Hukum kedua ini membahas tentang entropi. Taukah kalian apa itu entropi?
Entropi adalah tingkat ketidakteraturan atau tingkat ketidakstabuilan suatu sistem. Hukum kedua ini dicetuskan oleh ilmuan yang bernama Clausius dan Kelvin Plank.
a. Clausius
Tidak mungkin suatu sistem bekerja sehingga hasil satu-satunya adalah perpindahan energi sebagai panas dari sistem dengan temperatur tertentu ke sistem dengan temperatur yang lebih tinggi. Secara umum dapat dikatakan tidak mungkin suatu sistem dengan efisiensi 100%.
b. Kelvin Plank
Tidak mungkin suatu sistem beroperasi dalam siklus termodinamika dan memberikan sejumlah netto kerja kesekeliling sambil menerima energi panas dari satu reservoir termal. Total entropi dari suatu sistem tertutup akan meningkat seiring dengan lama waktu bekerja dan prosestersebut dinamakan kenaikan nilai entropi.
Hukum 3 Termodinamika
Hukum 3 ini membahas tentang temperature atau suhu 0 absolut. Hukum ini menyatakan bahwa saat sistem mencapai temperatur nol absolut, semua proses akan berhenti dan entropi sistem akan mendekati nilai minimum.
Hukum ini juga menyatakan bahwa entropi benda berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Selanjutnya semua peristiwa dan hokum ini dapat dituliskan secara matematis seperti dibawah ini.
Rumus Termodinamika
Dalammenyelesaikan berbagai persoalan termodinamika telah dirumuskan rumus atau persamaan termodinamika yaitu:
a. Hukum 1 Termodinamika
Q = W + ∆U
Dimana
- Q = kalor atau panas yang diterima atau dilepas (J)
- W = energi atau usaha (J)
- ∆U = perubahan energi (J)
b. Isobarik
W = P ∆V
Dimana
- W = energi atau usaha (J)
- P = nilai tekanan sistem (atm)
- ∆V = perubahan volume (L)
c. Isotermik
W = n R T ln(V2/V1)
Dimana
- W = energi atau usaha (J)
- n = molaritas larutan (mol)
- R = tetapan gas (J/K)
- V2/V1 = perbandingan volume larutan.
d. Adiabatik
W = -3/2 n R ∆T
Dimana
- W = energi atau usaha (J)
- n = molaritas larutan (mol)
- R = tetapan gas (J/K)
- ∆T = perubahan suhu (K)
Contoh Soal Termodinamika
Untuk menguji pemahaman kalian telah disediakan beberapa soal untuk melatihnya.
1. Suatu gas memiliki volume awal 20 m3 dipanaskan dengan kondisi isobaris hingga volume akhirnya menjadi 80 m3. Jika tekanan gas adalah 2 atm, tentukan usaha luar gas tersebut! (1 atm = 1,01 x 105 Pa).
Diketahui
V2 = 80 m3
V1 = 20 m3
P = 2 atm = 2,02 x 105 Pa
Penyelesaian
W = P (V2 − V1)
W = 2,02 x 105 x (80 − 20)
W = 12,12 x 106 J
Jadi, usaha luar gas tersebut adalah 12,12 x 106 J
2. 2000/693 mol gas helium pada suhu tetap 27oC mengalami perubahan volume dari 3,5 liter menjadi 6.5liter. Jika R = 8,314 J/mol K dan ln 2 = 0,693 tentukan usaha yang dilakukan gas helium!
Diketahui
n = 2000/693 mol
V2 = 6,5 L
V1 = 3,5 L
T = 27oC = 300 K
Penyelesaian
W = nRT ln (V2 / V1)
W = 2000/693 x 8,314 x 300 x ln (6,5 / 3,5)
W = 2000/693 x 8,314 x 300 x 0,619
W = 4456,0103 joule
Jadi, usaha yang dilakukan gas helium adalah sebesar 4456,0103 joule.
Demikian pembahasan dari PPKN.CO.ID Mengenai contoh soal hukum termodinamika, Semoga bermanfaat
Refrensi Teknologi : DISINI


